
要在欧盟(EU)销售医疗设备,您必须为您的产品获得或应用CE标志。CE标志表明您的医疗设备符合适用的欧盟法规,并允许您的产品在32个欧洲国家商业化。作为合法的医疗设备制造商,无论您是外包生产过程的任何部件还是全部部件,您都有责任维护法规合规性并确保产品具有CE标志。体外诊断 请参阅此页面。
一些欧盟成员国要求对投放市场的IIa,IIb或III类设备进行额外注册。
对于I类(非无菌,非测量),不需要年度NB审核。但是,您必须执行CER更新和PMS活动。
对于所有其他课程,每年都会由公告机构对您进行审核,以确保持续符合93/42 / EEC或90/385 / EEC。未通过审核将使您的CE标志证书无效。您必须执行CER更新和PMS活动。
步骤1
确定适用于您的设备的EU医疗设备指令:93/42 / EEC –医疗设备指令(MDD)或90/385 / EEC-有源可植入医疗设备指令(AIMDD):
步骤2
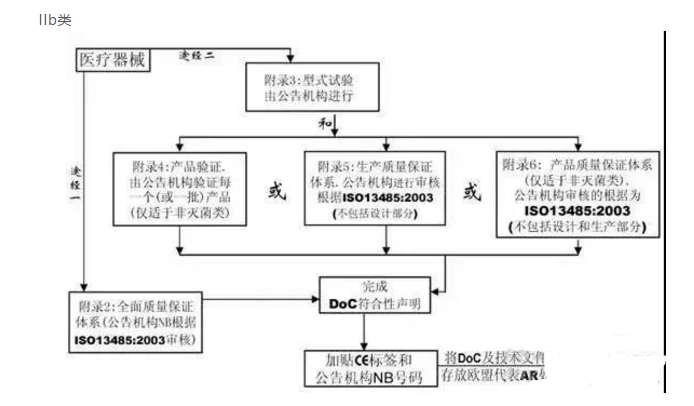
使用医疗器械指令(MDD)附录IX确定设备的分类:I类(非无菌,非测量),I类(无菌,测量),IIa类,IIb类或III / AIMD类。有源可植入医疗设备通常要与III类设备遵守相同的法规要求。
步骤3
对于除I类(非无菌,非测量)以外的所有设备,请按照MDD附件II或V实施质量管理体系(QMS)。
大多数公司都应用ISO 13485标准来达到QMS要求。
对于I类(非无菌,非测量),正式不需要QMS。但是,尽管没有经过公告机构(NB)的审核,仍需要PMS程序。
步骤4
对于I至IIb类,请准备一个技术文件,该文件提供有关您的医疗设备的详细信息,并证明符合93/42 / EEC。所有需要的设备都将需要临床数据。这些数据中的大多数应参考主题设备。
对于III / AIMD类设备,请准备设计卷宗。IIb和III类植入物需要进行临床研究,尽管现有的临床数据可能是可以接受的。在欧洲的临床试验必须事先获得欧洲主管当局的批准。
步骤5
如果您在欧洲没有分支机构,请任命一个位于欧洲的授权代表(EC Rep)。EC代表应具有处理法规问题的资格。将EC REP名称和地址放在使用说明,外包装或设备标签上。
步骤6
对于除I类(非灭菌,非测量)以外的所有设备,您的QMS和技术档案或设计卷宗必须经过指定机构的审核,该机构是经过欧洲当局认可的第三方来审核医疗设备公司和产品。
步骤7
对于除I类(非无菌,非测量)以外的所有设备,在成功完成公告机构审核后,将为您的设备获得欧洲CE标记证书,并为您的设施获得ISO 13485证书。每年必须更新ISO 13485认证。CE标志证书通常有效期为3年。
步骤8
准备合格声明,这是制造商准备的具有法律约束力的文件,表明设备符合适用的指令。您现在可以贴上CE标志。
步骤9
所有I类设备必须在您或您的EC REP所在的主管当局中注册。
一些欧盟成员国要求对投放市场的IIa,IIb或III类设备进行额外注册。
步骤10
对于I类(非无菌,非测量),不需要年度NB审核。但是,您必须执行CER更新和PMS活动。
对于所有其他课程,每年都会由公告机构对您进行审核,以确保持续符合93/42 / EEC或90/385 / EEC。未通过审核将使您的CE标志证书无效。您必须执行CER更新和PMS活动。
- 电烤盘ce认证标准 2024-11-21
- 牙膏测试标准和流程 2024-11-21
- 环保测试PAHS检测多环芳烃检测办理 2024-11-21
- 钢绞线检测办理标准是什么 2024-11-21
- PVC地板防火测试EN13501-1标准 2024-11-21
- 显示器能效测试怎么做? 2024-11-21
- 可燃性测试ENISO11925-2标准怎么做? 2024-11-21
- 蝶阀检测办理标准 2024-11-21
- 医疗器械测试怎么做? 2024-11-21
- 市场常见的电子电器的安全测试项目 2024-11-21
- TPCH包装材料测试 2024-11-21
- 欧盟发布EN71-2:2020测试新修订版 2024-11-21
- 什么是ERD认证? 2024-11-21
- 什么是LVD认证?怎么办理? 2024-11-21
- 什么是CE符合性声明 2024-11-21
联系方式
- 电 话:15815880040
- 经理:陈鹏
- 手 机:15815880040
- 传 真:0755-85228660
- 微 信:15815880040









