出口印度N95口罩测试标准

| 更新时间 2024-12-23 09:00:00 价格 1999元 / 个 联系电话 17324419148 联系手机 17324419148 联系人 陈鹏 立即询价 |
医用口罩
医用口罩需按照欧盟医疗器械指令93/42/EEC(MDD)或欧盟医疗器械条例EU2017/745(MDR)加贴CE标志,对应的标准是EN14683。根据口罩产品无菌或非无菌状态,采取的合格评定模式也不同。
(1)无菌医用口罩:必须由授权公告机构进行CE认证。
(2)非无菌医用口罩:企业只需进行CE自我符合性声明,不需要通过公告机构认证。在准备好相应文件及测试报告等资料后,即可自行完成符合性声明。
个人防护口罩
个人防护口罩不属于医疗器械,但需符合欧盟个人防护设备条例EU2016/425(PPE)要求,由授权公告机构进行CE认证并颁发证书,对应的标准是EN149。
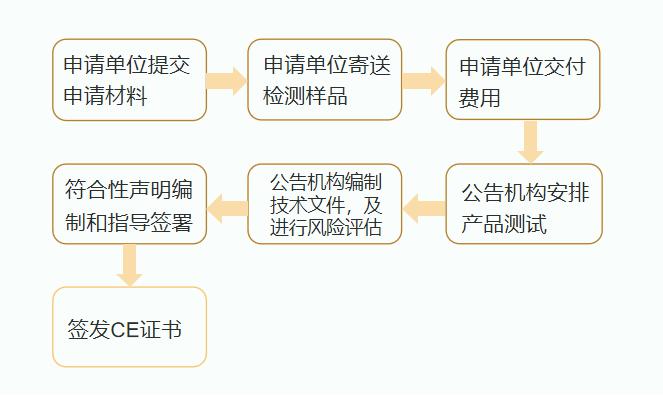
不同认证机构流程略有不同,大致流程如下:
CE认证变化
2020年5月26日, MDR指令在欧盟就将开始强制执行
根据目前欧盟新统计,拥有老指令版本MDD(93/42/EEC)授权的NB公告机构共有56家,而符合MDR授权的NB公告机构目前则仅有12家而已。也就是说,从2020年5月26日开始,针对医用口罩的CE认证审核机构可选性降低了80%;认证周期必然大幅度拉长,本次疫情期间有些机构声称的几天出证的可能性将基本为零;
BSI的CE快速认证
为应对疫情,英国标准协会(BSI)在响应欧盟额委员会在对产品CE认证谨慎把关的前提下,开启CE认证快速通道,用于疫情期间供医务人员所使用的PPE口罩的CE认证。该快速认证服务可以让整个认证周期缩短至3周左右。
快速认证方案 - 01
● 申请条件 ●
制造商持有NIOSH N95/N100或AS/NZS 1716:2012报告
● 可选认证模式 ●
Module B + Module C2 或
Module B + Module D
● 要点[1] ●
测试报告须出自北美,欧洲,澳洲新西兰的ISO 17025认可实验室
对于Module C2模式的执行,可先发Module C2证书,并在发证后执行Module C2随机抽样测试检查
Module D模式执行制造商质量体系审核,合格后颁发Module D证书
快速认证方案 - 02
Module B + Module C2
测试报告都须出自CNAS认可实验室
对于Module C2模式的执行,可先发证书,但须在Module B证书颁发后执行Module C2随机抽样测试检查
快速认证方案 - 03
对于Module C2模式的执行,可先发证书,但须在Module B证书颁发后执行Module C2随机抽样测试检查,并进行EN 149指定项目测试
快速认证方案 - 04
制造商持有非上述标准或技术规范的测试报告或不持有任何测试报告
须根据BSI的 EN 149技术规范进行测试
对于Module C2模式的执行,可先发证书,但须在Module B证书颁发后的6个月内执行Module C2随机抽样测试检查
更多详情联系航天检测技术深圳有限公司
联系方式
- 电 话:17324419148
- 经理:陈鹏
- 手 机:17324419148
- 传 真:0755-85228660
- 微 信:17324419148











