
CEMDR技术文件和欧代是什么?
新的欧盟医疗器械法规(EU MRDs)将对在欧盟内开展贸易的所有制造商的标签流程产生重大影响。新法规影响深远,标签流程也因此成了公司的头等大事。标签标注不、不符合MDR要求都有可能造成公司无法继续在欧洲销售其产品,从而造成大量库存积压,甚至引发成本高昂且损害公司声誉的产品召回事件。
1 法规要求
先来看一下MDR法规的具体要求:

法规附录I中III章23.2对于产品标签要求必须注明:
(a) 器械的名称或商品名称;
(b) 使用者识别器械所必需的详细信息、包装内容以及对于使用者不明显的器械预期用途;
(c) 制造商的名称、注册商号或注册商标及其注册营业地点的地址;
(d) 授权代表的姓名和授权代表的注册营业地点地址(若制造商在欧盟以外有其注册营业地点);
(e) 若没有指明可安全使用的日期,则指明制造日期。若日期清晰可辨,制造日期可作为批号或序列号的一部分。
(f) 指明适用的任何特殊储存和/或处理条件;
(g) 若以无菌方式提供器械,还应指示其无菌状态和灭菌方法;
(h) 需要立即引起器械使用者和任何其他人的注意、需要采取的警戒或预防措施。
该信息可保持小量,在这种情况下,更详细的信息将出现在使用说明中,同时考虑到预期使用者;
(i) 若器械用于一次性使用,则相应指明。制造商的一次性使用指示应在整个欧盟内保持一致;
(j) UDI 载体应添加在该器械标签和所有更大包装上;
(k) 标签应明显、清晰和不可磨灭地添加在器械或其无菌包装上。考虑到器械性质,无法或不适合将标签添加到器械上时,应将 CE 标识添加在包装上。CE 标识也应加贴在有使用说明和任何销售包装中;
(l) 应采用器械上市国(同时也是成员国)的欧盟官方语言编写,也可以采用预销往国的当地语言;
(m) 标签上所需的信息应在器械本身上提供。若不可行或不适当,则某些或所有信息可显示在各单元的包装上和/或多个器械的包装上。
2 标识举例

那么到底哪些标识是在标签(包装)上必须体现的呢?
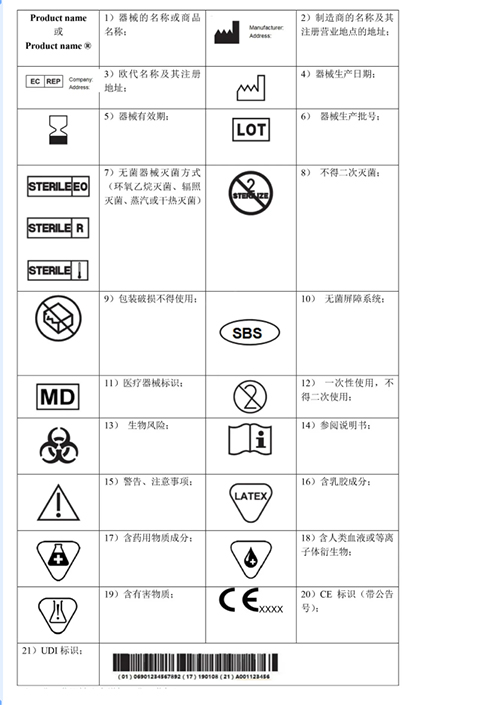
常用无源器械标识
注:非灭菌器械注意增加“非灭菌标识”。
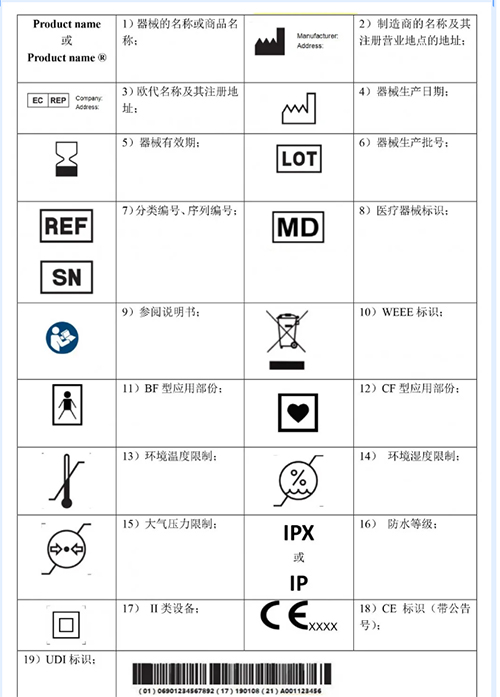
常用有源器械标识
注:有源器械涉及的标识很多,需根据器械的专标要求进行补充。
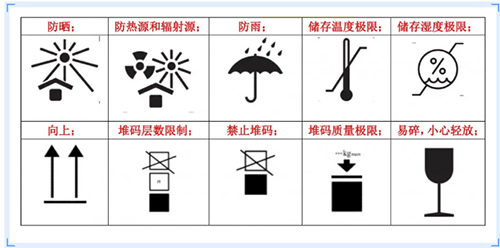
常用的包装标识
注:制造商信息、欧代信息和外包装UDI可以体现在外包装上。
3 结语
注意!企业如果想变更标签上的信息,比如器械名称或商品名称、规格型号、制造商名称和地址、欧代名称和地址、器械有效期、灭菌方式发生改变时,应及时通知公告机构,经评审确认无误后方可使用新标签。擅自使用不符合要求的标签会有被勒令召回的风险(MDR一类器械除外)。虽然MDR一类器械没有公告机构评审,但设计标签时仍需满足MDR法规附录I 23.2条的要求。
- 蓝牙WIFI模块墨西哥IFETEL认证证书办理流程 2024-12-22
- 肯尼亚PVOC认证证书报告怎么办理? 2024-12-22
- 运动相机CE ROHS认证 2024-12-22
- 红外线测温播报仪CE认证 2024-12-22
- 儿童服饰是否需要CE认证?是否需要DoC符合性声明? 2024-12-22
- 氢燃料电池CE认证 2024-12-22
- 儿童服饰是否需要CE认证? 2024-12-22
- 光伏逆变器的CE认证证书 2024-12-22
- 一类有源医疗器械检验 2024-12-22
- 医疗器械13485认证 2024-12-22
